¡Tu solución está lista!
Nuestra ayuda de expertos desglosó tu problema en una solución confiable y fácil de entender.
Mira la respuestaMira la respuesta done loadingPregunta: An aqueous solution of ethanol and acetic acid, each with a concentration of 0.810 M, is heated to 100oC. At equilibrium, the acid concentration is 0.748 M. What would the concentrations of each of the compounds be if 0.3 moles of ethanol were added to the mixture?
An aqueous solution of ethanol and acetic acid, each with a concentration of 0.810 M, is heated to 100oC. At equilibrium, the acid concentration is 0.748 M. What would the concentrations of each of the compounds be if 0.3 moles of ethanol were added to the mixture?
- Esta es la mejor manera de resolver el problema.Solución
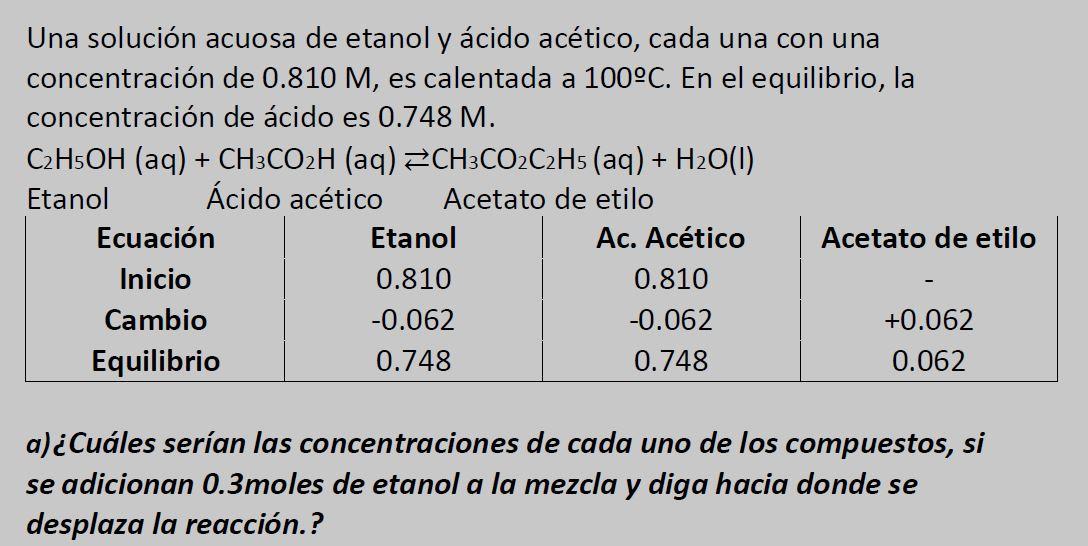
Texto de la transcripción de la imagen:
Una solución acuosa de etanol y ácido acético, cada una con una concentración de 0.810 M, es calentada a 100°C. En el equilibrio, la concentración de ácido es 0.748 M. C2H5OH (aq) + CH3CO2H (aq) =CH3CO2C2H5 (aq) + H2O(1) Etanol Ácido acético Acetato de etilo Ecuación Etanol Ac. Acético Acetato de etilo Inicio 0.810 0.810 Cambio -0.062 -0.062 +0.062 Equilibrio 0.748 0.748 0.062 a) ¿Cuáles serían las concentraciones de cada uno de los compuestos, si se adicionan 0.3moles de etanol a la mezcla y diga hacia donde se desplaza la reacción.?

Estudia mejor, ¡ahora en español!
Entiende todos los problemas con explicaciones al instante y pasos fáciles de aprender de la mano de expertos reales.