¡Tu solución está lista!
Nuestra ayuda de expertos desglosó tu problema en una solución confiable y fácil de entender.
Mira la respuestaMira la respuesta done loadingPregunta: Un mineral de hierro se analizó disolviendo 2.312 g una muestra en HCI concentrado. La solución resultante se diluyó con agua y el hierro se precipitó como óxido hidratado F₂O3.XH20 al añadir NH3. Después de la filtración y lavado, el residuo se calcinó a alta temperatura para dar 1.38 gr de Fe2O3 (159.69 g/mol). Determinar el % de Fe3O4 (231.54g/mol),
Un mineral de hierro se analizó disolviendo 2.312 g una muestra en HCI concentrado. La solución resultante se diluyó con agua y el hierro se precipitó como óxido hidratado F₂O3.XH20 al añadir NH3. Después de la filtración y lavado, el residuo se calcinó a alta temperatura para dar 1.38 gr de Fe2O3 (159.69 g/mol). Determinar el % de Fe3O4 (231.54g/mol),- Hay 3 pasos para resolver este problema.SoluciónPaso 1Mira la respuesta completa
De acuerdo a los datos del enunciado tenemos que el proceso descripto puede ser resumido según la re...
Paso 2 DesbloqueaPaso 3DesbloqueaRespuestaDesbloquea
DesbloqueaPaso 3DesbloqueaRespuestaDesbloquea
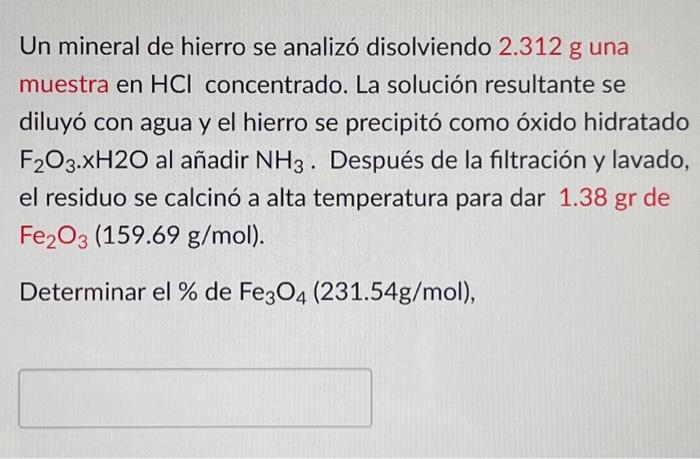
Texto de la transcripción de la imagen:
Un mineral de hierro se analizó disolviendo 2.312 g una muestra en HCl concentrado. La solución resultante se diluyó con agua y el hierro se precipitó como óxido hidratado F2O3×xH2O al añadir NH3. Después de la filtración y lavado, el residuo se calcinó a alta temperatura para dar 1.38gr de Fe2O3(159.69 g/mol). Determinar el % de Fe3O4(231.54 g/mol),

Estudia mejor, ¡ahora en español!
Entiende todos los problemas con explicaciones al instante y pasos fáciles de aprender de la mano de expertos reales.