¡Tu solución está lista!
Nuestra ayuda de expertos desglosó tu problema en una solución confiable y fácil de entender.
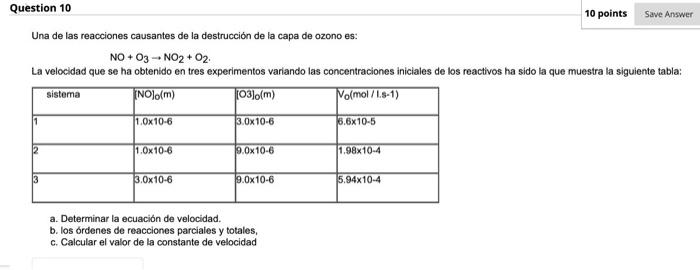
Mira la respuestaMira la respuesta done loadingPregunta: Save Answer Question 10 10 points Una de las reacciones causantes de la destrucción de la capa de ozono es: NO+O3 -- NO2 + O2 La velocidad que se ha obtenido en tres experimentos variando las concentraciones iniciales de los reactivos ha sido la que muestra la siguiente tabla: Sistema (NO)o(m) 103)o(m) Yolmol/L.9-1) 11 1.0x10-6 3.0x10-6 6.6x10-5 2 1.0x10-6
One of the reactions that causes the destruction of the ozone layer is: NO + 03 - NO2 + 02. The speed that has been obtained in three experiments varying the initial concentrations of the reagents has been shown in the following table:
a. Determine the rate equation.
b. the orders of partial and total reactions,
c. Calculate the value of the rate constant
- Esta es la mejor manera de resolver el problema.SoluciónTe mostramos cómo abordar esta pregunta.
Este consejo generado con IA está basado en la solución completa de Chegg. ¡Regístrate para ver más!
Write the rate law expression as using the given data from the table.

Texto de la transcripción de la imagen:
Save Answer Question 10 10 points Una de las reacciones causantes de la destrucción de la capa de ozono es: NO+O3 -- NO2 + O2 La velocidad que se ha obtenido en tres experimentos variando las concentraciones iniciales de los reactivos ha sido la que muestra la siguiente tabla: Sistema (NO)o(m) 103)o(m) Yolmol/L.9-1) 11 1.0x10-6 3.0x10-6 6.6x10-5 2 1.0x10-6 9.0x10-6 1.98x10-4 13 3.0x10-6 9.0x10-6 5.94x10-4 a. Determinar la ecuación de velocidad. b. los órdenes de reacciones parciales y totales, c. Calcular el valor de la constante de velocidad
Una de las reacciones causantes de la destrucción de la capa de ozono es: NO+O3 -- NO2 + O2 La velocidad que se ha obtenido en tres experimentos variando las concentraciones iniciales de los reactivos ha sido la que muestra la siguiente tabla: sistema (NO)o(m) (03).(m) Nomol/L.S-1) 1 1.0x10-6 3.0x10-6 5.6x10-5 12 1.0x10-6 9.0x10-6 1.98x10-4 3 3.0x10-6 9.0x10-6 5.94x10-4 a. Determinar la ecuación de velocidad. b. los órdenes de reacciones parciales y totales, c. Calcular el valor de la constante de velocidad

Estudia mejor, ¡ahora en español!
Entiende todos los problemas con explicaciones al instante y pasos fáciles de aprender de la mano de expertos reales.