¡Tu solución está lista!
Nuestra ayuda de expertos desglosó tu problema en una solución confiable y fácil de entender.
Mira la respuestaMira la respuesta done loadingPregunta: Graph of In P vs 1/T for a pure liquid. P is the vapor pressure (in atm) and T is the temperature (in K). The graph shows the equation of the line corresponding to the data. From the
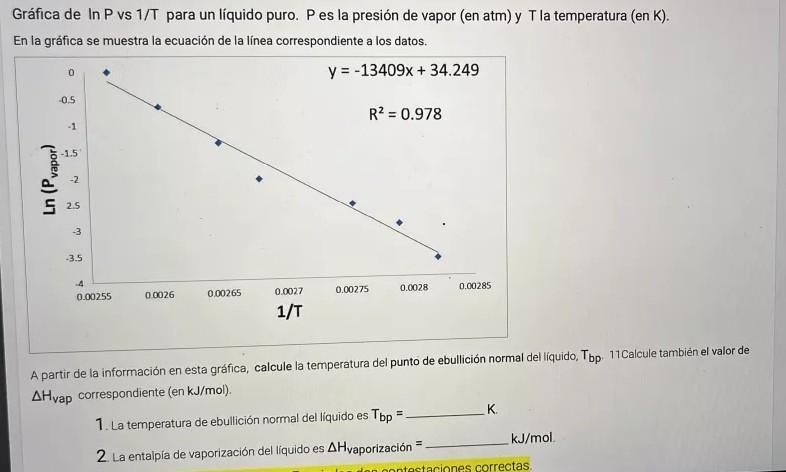
Graph of In P vs 1/T for a pure liquid. P is the vapor pressure (in atm) and T is the temperature (in K).
The graph shows the equation of the line corresponding to the data.From the information on this graph, calculate the normal boiling point temperature of the liquid, Tbp. Also calculate the corresponding ΔHvap value (in kJ/mol).
1. The normal boiling temperature of the liquid is Tbp = in units of K
2. The vaporization enthalpy of the liquid is ΔHvap= in unita of kJ/mol
- Esta es la mejor manera de resolver el problema.Solución100% (1 calificación)
Texto de la transcripción de la imagen:
Gráfica de In P vs 1/T para un líquido puro. Pes la presión de vapor (en atm) y Tla temperatura (en K). En la gráfica se muestra la ecuación de la linea correspondiente a los datos. y = -13409x + 34.249 0 -0.5 R2 = 0.978 -1.5 Ln (Pvapor) -2 5 25 -3 -3.5 4 0.00255 0.00275 0.0028 0.00285 0.0027 0.0026 0.00265 1/T = A partir de la información en esta gráfica, calcule la temperatura del punto de ebullición normal del líquido, Top 11 Calcule también el valor de AHvap correspondiente (en kJ/mol). 1. La temperatura de ebullición normal del líquido es Tbp = K. 2. La entalpia de vaporización del líquido es AHvaporización kJ/mol on nontestaciones correctas.

Estudia mejor, ¡ahora en español!
Entiende todos los problemas con explicaciones al instante y pasos fáciles de aprender de la mano de expertos reales.
