¡Tu solución está lista!
Nuestra ayuda de expertos desglosó tu problema en una solución confiable y fácil de entender.
Mira la respuestaMira la respuesta done loadingPregunta: De acuerdo a la ecuación mostrada, ¿cuántos moles de agua se producen en la combustión de 0.10 moles de glucosa? C6H12O6 + 6 O2 → 6 CO2 + 6H2O O E 725 Mosty cloudy 60 4400 M 20/202 Estime la masa de Co, producida en el año 2006 por la combustión de 3.5 x 1015 g octano. Mm C3H18 = 114.22 g/mol. Mm CO2 = 44.01 g/mol. = La ecuación balanceada de la reacción
- Esta es la mejor manera de resolver el problema.Solución100% (1 calificación)
As per the Chegg guidelines I will be solving the first question only. 0.60 mol of water will be prod…
Mira la respuesta completa
Texto de la transcripción de la imagen:
De acuerdo a la ecuación mostrada, ¿cuántos moles de agua se producen en la combustión de 0.10 moles de glucosa? C6H12O6 + 6 O2 → 6 CO2 + 6H2O O E 725 Mosty cloudy 60 4400 M 20/202
Estime la masa de Co, producida en el año 2006 por la combustión de 3.5 x 1015 g octano. Mm C3H18 = 114.22 g/mol. Mm CO2 = 44.01 g/mol. = La ecuación balanceada de la reacción es: 2 C3H18 (1) + 25 O2 (g) → 16 CO2 (g) + 18 H,0 (9) O search O 27 72"F Mostly cloudy DI 5
Page view A Head soud Adid V Draw & Highlight - re Para la reacción química mostrada abajo, reaccionan 28.6 kg de C (Mm = 12.01 g/mol) con 88.2 kg de TiO2 (Mm = 79.87 g/mol) y se obtienen 42.8 kg de Ti (Mm = 47.87 g/mol) experimentalmente. Determine: el reactivo limitante, el rendimiento teórico y el porciento de rendimiento. TiO2 (s) + 2 C(s) + Ti (s) + 2 CO (9)
Page View Aste V ¿Cuántos gramos de N2 (9) (Mm = 28.02 g/mol) se producen cuando 9.05 g de NH3 (Mm = 17.03 g/mol) reaccionan con 45.2 g de CuO (Mm = 79.55 g/mol)? 2 NH3(g) + 3 CuO (s) - N, (g) + 3 Cu (s) + 3 H20 (1) Si se obtienen 4.61 g de N2, ¿cuál es el porciento de rendimiento? hosto O
Encontrar la fórmula molecular de butanodiona (FE: C2H2O), Mm = 86.09 g/mol o search o 3 73°F Mostly cloudy & 400 7.6 FM 1/28/2002
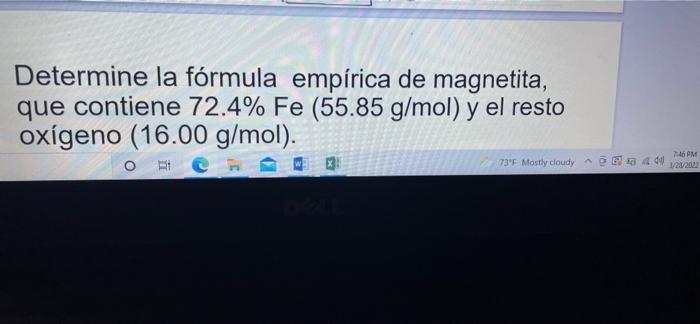
Determine la fórmula empírica de magnetita, que contiene 72.4% Fe (55.85 g/mol) y el resto oxígeno (16.00 g/mol). ht O 73'F Mostly cloudy 746 PM 404 1/21/2002
¿Cuántos gramos de carbono hay en una muestra de 7.25 mL de butano (C4H10)? La densidad de butano es 0.601 g/mL. Mm butano = 58.14 g/mol, Mm C = 12.01 g/mol. - 73F. Mostly doudy 400 te 1
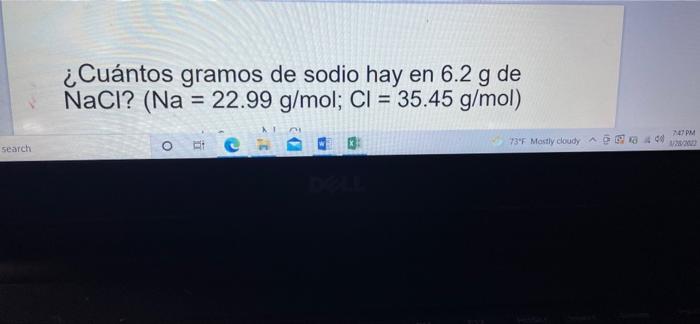
¿Cuántos gramos de sodio hay en 6.2 g de NaCl? (Na = 22.99 g/mol; Cl = 35.45 g/mol) MT 747 PM re Search 737 Mostly cloudy A400 3
Determine el número de moléculas de ibuprofeno en una tableta que contiene 200.0 mg de ibuprofeno (C13H1802). Mm = 206.31 g/mol 3 73F Mostly cloudy 400 to search

Estudia mejor, ¡ahora en español!
Entiende todos los problemas con explicaciones al instante y pasos fáciles de aprender de la mano de expertos reales.