¡Tu solución está lista!
Nuestra ayuda de expertos desglosó tu problema en una solución confiable y fácil de entender.
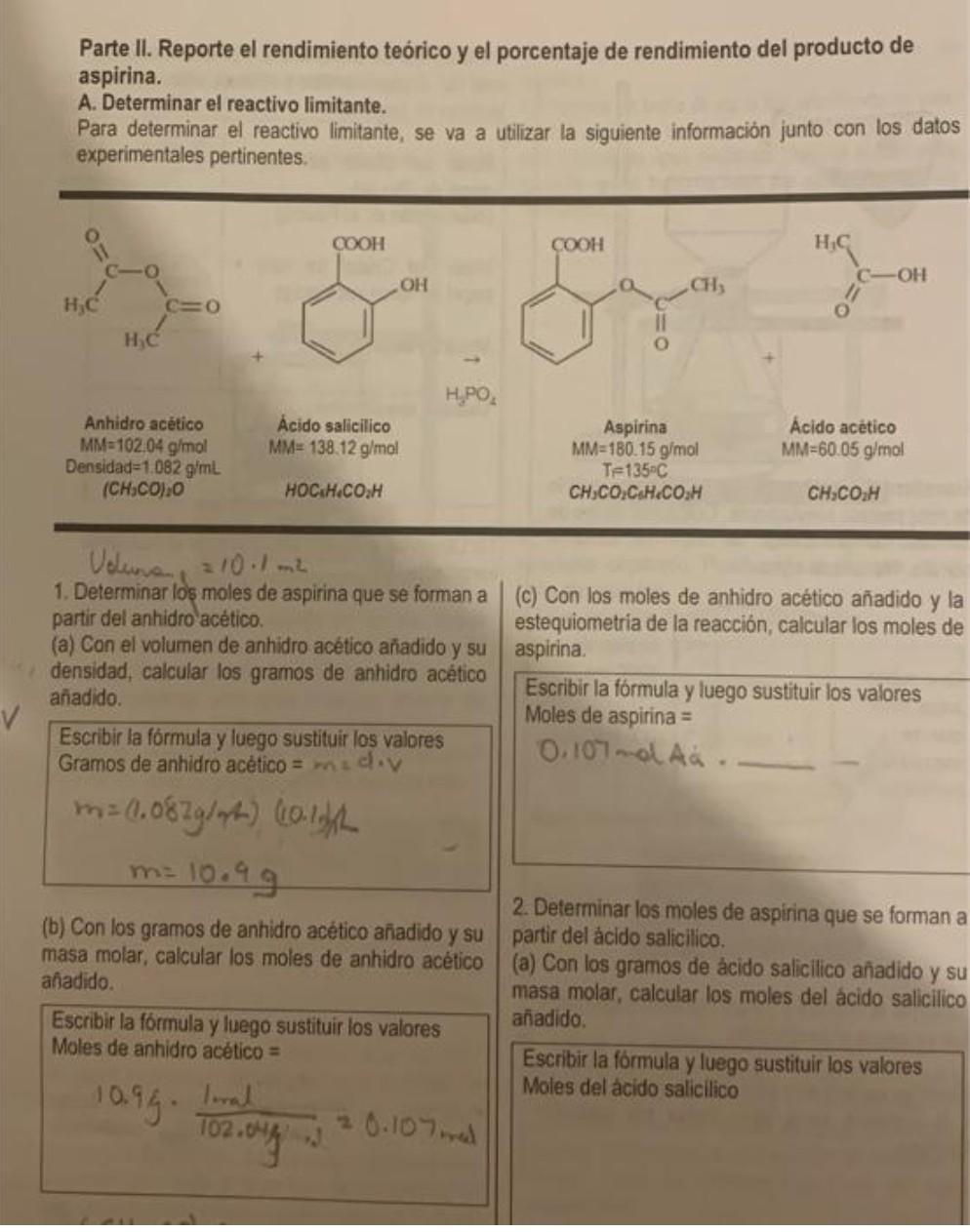
Mira la respuestaMira la respuesta done loadingPregunta: Parte II. Reporte el rendimiento teórico y el porcentaje de rendimiento del producto de aspirina. A. Determinar el reactivo limitante. Para determinar el reactivo limitante, se va a utilizar la siguiente información junto con los datos experimentales pertinentes. Velewne =10⋅1 m2 1. Determinar los moles de aspirina que se forman a (c) Con los moles de
Data:
The second question's answer is: 5.096g/138.12g/mol.
Help with this part:

(b) Using the moles of salicylic acid added and the stoichiometry of the reaction, calculate the moles of aspirin.
3. Identify which was the limiting reactant
4. Determine the theoretical yield in grams of aspirin from the limiting reagent.
5. Determine the percent yield for reaction
.
- Hay 4 pasos para resolver este problema.SoluciónPaso 1Mira la respuesta completa
2. Determinar los moles de aspirina que se forman a partir del ácido salicilico
a. La formula es la s...
Paso 2 DesbloqueaPaso 3DesbloqueaPaso 4DesbloqueaRespuestaDesbloquea
DesbloqueaPaso 3DesbloqueaPaso 4DesbloqueaRespuestaDesbloquea
Texto de la transcripción de la imagen:
Parte II. Reporte el rendimiento teórico y el porcentaje de rendimiento del producto de aspirina. A. Determinar el reactivo limitante. Para determinar el reactivo limitante, se va a utilizar la siguiente información junto con los datos experimentales pertinentes. Velewne =10⋅1 m2 1. Determinar los moles de aspirina que se forman a (c) Con los moles de anhidro acético añadido y la partir del anhidro acético. estequiometria de la reacción, calcular los moles de (a) Con el volumen de anhidro acético añadido y su aspirina. densidad, calcular los gramos de anhidro acético añadido. Escribir la fórmula y luego sustituir los valores Moles de aspirina = Escribir la fórmula y luego sustituir los valores Gramos de anhidro acético =m a el. V 0.107 mol. Ȧ் . m=(1.082 g/m)(10.1 m)(1m=10.99 2. Determinar los moles de aspirina que se forman a (b) Con los gramos de anhidro acético añadido y su partir del acido salicilico. masa molar, calcular los moles de anhidro acético (a) Con los gramos de ácido salicilico añadido y su anadido. masa molar, calcular los moles del ácido salicilico Escribir la formula y luego sustituir los valores añadido, Moles de anhidro acético = Escribir la formula y luego sustituir los valores 10.9 g⋅102.04/3+2 lral =0.107 med Moles del acido salicilico
(b) Con los moles del ácido salicilico añadido y la 4. Determine el rendimiento teórico en gramos de estequiometría de la reacción, calcular los moles de aspirina a partir del reactivo limitante. aspirina. Escribir la fórmula y luego sustituir los valores Escribir la fórmula y luego sustituir los valores Moles de aspirina = Gramos teóricos de aspirina = 3. Identifique cuál fue el reactivo limitante. 5. Determine el por ciento de rendimiento para reacción: % Rendimiento = gramos de aspirina teoˊ gramos de aspirina exp ×100

Estudia mejor, ¡ahora en español!
Entiende todos los problemas con explicaciones al instante y pasos fáciles de aprender de la mano de expertos reales.