¡Tu solución está lista!
Nuestra ayuda de expertos desglosó tu problema en una solución confiable y fácil de entender.
Mira la respuestaMira la respuesta done loadingPregunta: Under certain conditions, the equilibrium constant for the decomposition of PCI5 (g) into PCI3(g) and Cl2 (g) is 0.0211. What are the equilibrium concentrations of PCI5, PCI3 and Cl if the initial concentration of PCI5 was 1.00 M?
Under certain conditions, the equilibrium constant for the decomposition of PCI5 (g) into PCI3(g) and Cl2 (g) is 0.0211. What are the equilibrium concentrations of PCI5, PCI3 and Cl if the initial concentration of PCI5 was 1.00 M?- Hay 3 pasos para resolver este problema.SoluciónPaso 1Mira la respuesta completa
Nuestra reacción a estudiar es
PCl5(g) ⇌ PCl3(g) + Cl2(g)
La constante de equilibrio para esta reacci...
Paso 2 DesbloqueaPaso 3DesbloqueaRespuestaDesbloquea
DesbloqueaPaso 3DesbloqueaRespuestaDesbloquea
Texto de la transcripción de la imagen:
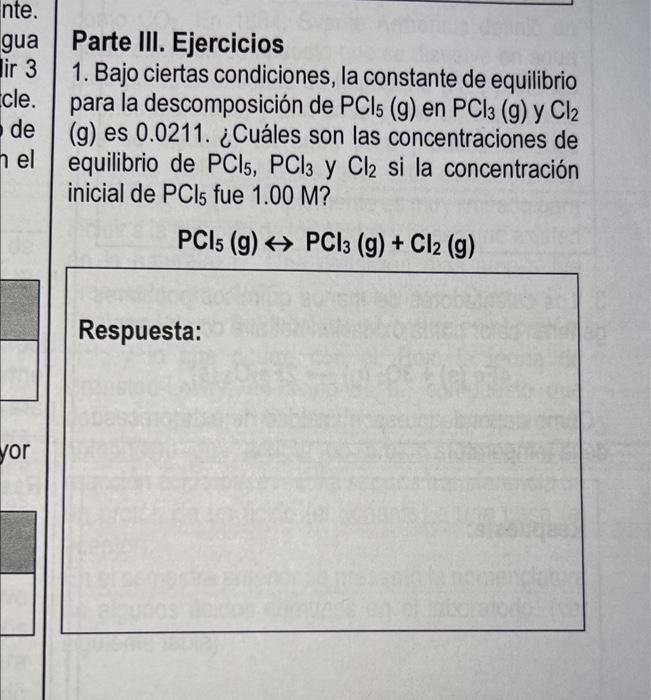
Parte III. Ejercicios 1. Bajo ciertas condiciones, la constante de equilibrio para la descomposición de PCl5 (g) en PCl3( g ) y Cl2 (g) es 0.0211. ¿Cuáles son las concentraciones de equilibrio de PCl5,PCl3 y Cl2 si la concentración inicial de PCl5 fue 1.00M ? PCl5( g)↔PCl3( g)+Cl2( g)

Estudia mejor, ¡ahora en español!
Entiende todos los problemas con explicaciones al instante y pasos fáciles de aprender de la mano de expertos reales.