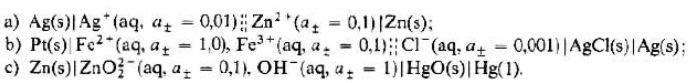¡Tu solución está lista!
Nuestra ayuda de expertos desglosó tu problema en una solución confiable y fácil de entender.
Mira la respuestaMira la respuesta done loadingPregunta: Calculate the cell potential and find the cell reaction for each of the cells (data from table 17.1)Is the cell reaction spontaneous in all cases?
Calculate the cell potential and find the cell reaction for each of the cells (data from table 17.1)Is the cell reaction spontaneous in all cases?- Esta es la mejor manera de resolver el problema.SoluciónTe mostramos cómo abordar esta pregunta.
Este consejo generado con IA está basado en la solución completa de Chegg. ¡Regístrate para ver más!
Identify the half-reactions at the anode and cathode for the galvanic cell to determine the overall cell reaction.

Texto de la transcripción de la imagen:
Tabla 17.1 Potenciales de electrodo estándar a 25 C Reacción de electrodo V = - Fe K+ + c =K -2.925 Na + Na -2.714 H + 20 2H -2.25 Alp. + 3 = AI -1.66 Zn(CN) + 2e-Zn + 4CN- -1.26 ZnO + 2H,0 + 24 - Zn +40H -1.216 Zn(NHJ) + 2% - Z + 4NH, -1.03 Sn(OH),- +2e=H500+H.0+30H -0,90 Fe(OH), + 2e = Fe - 20H -0.877 2H,0 + 2e = H, +20H -0,828 Fe(OH), + 3e = Fe + 3OH -0.77 Zn2+ + 2e - Zn -0,763 Ag2S + 2c 2Ag +S- -0.69 Fe'- + 2e -0,440 BiO, + 3H,0 + 6 = 2B-60H- -0.44 PbSO. + 2e - Pb + SO -0.356 Ag(CN)+ e* = Ag + 2CN -0.31 Ni2+ + 2e = Ni -0,250 Agl + c Ag + 1 -0.151 Sn- + 2 = Sn -0.136 Pb2+ 20 = Pb -0.126 Cu(NH)] + 2e - Cu + 4NH, -0,12 Fe + 3e - Fe -0.036 2H + 2e H, 0.000 AgBr + e-Ag + Br +0.095 HgO(r) + H,0 + 20 = Hg + 20H +0,098 Snº+ + 20 Sn? +0.15 AgCl + c = Ag + a1 +0.222 Hg,CI, + 20-2Hg + 201" +0.2676 Cu + 2 = Cu +0.337 Ag(NH) + = Ag + 2NH, +0.373 Hg,SO, + 2 = 2Hg + SO +0.6151 Fel- + +0.771 Ag + c = Ag +0,7991 0, +4H + 4e-2H,0 +1.229 PbO, + S0 + 4H+ + 2 = PbSO. + 2H,0 +1.685 o, + 2H + 2 = 0, +H.O +2.07 Los valores de esta tabla se reproducen con permiso de W. M Latimer. The Oxidation States of the Elements and Their Potentials in 4qwcows Solution, 2. ed. Prentice-Hall. Englewood Cliffs. Nueva Jersey, 1952 Fe-
a) Ag(5) Ag+ (aq, at -0,01); Zn (ax = 0,1)Zn(s); b) Pt(s) Fe2+ (aq, az = 1,0), Fe3+ (aq, a. -0,1); CI+ (aq, ay = 0,001)|AgCl(s) Ag(s): )| c) Zn(s)|ZnO2 (aq, a. -0,1), OH(aq, 4+ - 1)|HgO(s)| Hg(1). ).

Estudia mejor, ¡ahora en español!
Entiende todos los problemas con explicaciones al instante y pasos fáciles de aprender de la mano de expertos reales.