¡Tu solución está lista!
Nuestra ayuda de expertos desglosó tu problema en una solución confiable y fácil de entender.
Mira la respuestaMira la respuesta done loadingPregunta: Buen día, podrían hacerme el favor de explicarme lo siguiente:NOTA: ya sé que las prácticas de laboratorio son meramente para el desarrollo de habilidades en un laboratorio, pero mi propósito es obtener conocimiento del por qué sucede cada fenómeno durante una práctica, para un mejor análisis y comprensión de lo que sucede, por lo que les agradecería mucho
Buen día, podrían hacerme el favor de explicarme lo siguiente:
NOTA: ya sé que las prácticas de laboratorio son meramente para el desarrollo de habilidades en un laboratorio, pero mi propósito es obtener conocimiento del por qué sucede cada fenómeno durante una práctica, para un mejor análisis y comprensión de lo que sucede, por lo que les agradecería mucho pudieran ser MUY específicos en mis dudas, por favor.
De acuerdo al inciso A)
¿por qué se hace una mezcla de hexano y etanol para machacar la espinaca? ¿por qué no se utilizó otros compuestos? ¿cuál es el propósito del hexano y el etanol y por qué exactamente esas cantidades y no más o menos? ¿Para qué se debe obtener un extracto cristalino y no uno turbio? ¿por qué se debe evitar las emulsiones? ¿Qué cumple el Na2SO4 cuando se transfiere la fase orgánica al tubo de ensayo? Se supone que es para eliminar el agua, pero ¿cómo? ¿qué pasa?
De acuerdo al inciso B)
¿Por qué se le vacia el capilar de 3-5 veces? ¿se podría contaminar las fases móviles si agrego más de la fase móvil mientras la placa está corriendo? si sí o no ¿por qué sucede, por qué se contamina?
De acuerdo al inciso C)
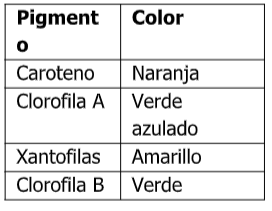
¿por qué se preparan mezclas diferentes? ¿cuál es el propósito? ¿qué importancia tienen los colores? ¿qué nos dice cada uno que viene por ejemplo en la tabla de pigmentos? ¿cómo se puede considerar viable una fase movil para la separación? ¿qué debemos tomar en cuenta?
Para este inciso, se corrieron 17 fases móviles desconocidas, las cuales las imágenes son las siguientes con sus respectivos números, favor de reportar los resultados obtenidos en la separación para cada una de las mezclas utilizadas como
eluyentes en términos de los pigmentos separados que vienen en la tabla de pigmentos (más abajo), además de por favor explicar por qué tal fase móvil no funcionó, funcionó o funcionó muy poco, ¿a qué se debe? ¿ qué quiere decirnos estos resultados? :placa con fase móvil 17 (color amarillento hasta arriba)
placa con fase móvil 13 (color amarillento más fuerte hasta arriba de la placa, se seleccionó esta para pasar a columna) ¿por qué?
placa con fase móvil 11 (igual color amarillo)
placa con fase móvil 16 (color verdoso)
placa con fase móvil 8 (también se seleccionó, ya que se observó color verde inferior y una separación a color amarillo a más arriba)
placa con fase móvil 4 (color amarillento arriba)
placa con fase móvil 1 (color amarillento abajo al inicio)
placa con fase móvil 12 (un color amarillo más marcado)
placa con fase móvil 10 (color amrillo poco verdoso)
placa con fase móvil 2 (color amarillo poco verdoso)
placa con fase móvil 9 (color amarillo poco marcado)
placa con fase móvil 3 (color amarillo muy poco marcado)
placa con fase móvil 5 (color verde marcado levemente)
placa con fase móvil 7 (color entre amarillo y verde levemente marcado)
placa con fase móvil 6 (color entre amarillo y verde casi nada marcado)
De acuerdo al inciso D) ¿por que se le agrega sílica gel? ¿Por qué se le agrega etanol para la humectación de la columna y no otra sustancia? ¿por qué evita que se fracture? ¿qué sucede, por qué cumple esto último? ¿por qué debe estar permeado todo el etanol para poder agregar la muestra?
¿Qué pasa si se fractura? ¿qué son los pigmentos obtenidos en los tubos de ensaye? ¿para qué?
TODO ESTO DE ACUERDO A LA SIGUIENTE PRÁCTICA: (me comprometo a puntearles)
Separación de los Pigmentos de la Hoja de Espinaca
Mediante Cromatografía en Capa Fina y ColumnaDesarrollo:
A) Extracción de pigmentos
1. En un mortero, colocar una hoja de espinaca fresca en trozos con una mezcla de 8 mL de hexano y 4 mL
de etanol, machacar suavemente para obtener un extracto cristalino.
2. Con una pipeta Pasteur transferir el extracto cristalino de hexano (superior) a un tubo de ensayo.
3. Adicionar aproximadamente la mitad del volumen de extracto de agua destilada y agitar con suavidad
evitando la formación de emulsiones.
4. Transferir la fase orgánica a un tubo de ensayo y añadir Na 2 SO 4 para eliminar el agua.B) Preparación de la placa de cromatografía
1. Con la ayuda de un lápiz marcar levemente los dos puntos en donde se va depositar la muestra.
2. Con un capilar, depositar un poco de la muestra sobre la placa de cromatografía; para evitar que la
mezcla difunda por la placa, vaciar el contenido del capilar poco a poco sobre un mismo punto (3-5
veces), y soplar suavemente para secar el disolvente.C) Desarrollo de la placa
1. Preparar 10 mL de los siguientes disolventes y mezclas de los mismos.
2. Preparar y cortar placas de papel para cada una de las fases móviles.
3. Correr la cromatografía y marcar con lápiz los resultados obtenidos para cada una de las fases móviles.
4. Determinar los colores presentes en cada una de las separaciones y calcular el R f para cada uno.
5. Reportar los resultados obtenidos en la separación para cada una de las mezclas utilizadas como
eluyentes en términos de los pigmentos separados, posiblemente:6. A partir de los valores de R f determinados y comparados con los reportados en la bibliografía, indicar cuál
sería la fase móvil más adecuada para realizar la separación.
7. Una vez seleccionada la fase móvil, repetir la cromatografía en una placa de capa fina.
D) Preparación de columna Cromatográfica1. Para empacar la columna, colocar un trozo pequeño de algodón en la parte inferior de una jeringa de 5
mL a manera de tapadera, agregar sílica gel hasta un 80% de la capacidad de la jeringa y compactarla;
colocar otro tapón de algodón en la parte superior de la jeringa.
2. Agregar etanol para humectar la columna y evitar que esta se fracture.
3. Una vez permeado todo el etanol, agregar la muestra y dejar que se difunda a través del algodón hasta
que alcance la sílica gel.
4. Agregar la fase móvil con la cual se observó la mejor separación por cromatografía en capa fina y
recolectar los pigmentos obtenidos en tubos de ensaye (uno para cada pigmento).Good morning, could you do me the favor of explaining the following:
NOTE: I know that the laboratory practices are merely for the development of skills in a laboratory, but my purpose is to obtain knowledge of why each phenomenon happens during a practice, for a better analysis and understanding of what happens, so I would really appreciate it if you could be VERY specific in my doubts, please.
According to part A) why is a mixture of hexane and ethanol made to mash the spinach? Why weren't other compounds used? what is the purpose of the hexane and ethanol and why exactly those amounts and not more or less? Why should a crystalline extract be obtained and not a cloudy one? Why should emulsions be avoided? What does the Na2SO4 do when the organic phase is transferred to the test tube? It's supposed to remove water, but how? what's happening?
According to subparagraph B)
Why is the capillary emptied 3-5 times? Could I contaminate the mobile phases if I add more mobile phase while the board is running? yes or no, why does it happen, why is it contaminated?
According to part C) why are different mixtures prepared? What is the purpose? How important are the colors? What does each one that comes in the pigment table tell us? How can a mobile phase be considered viable for separation? what should we take into account?
For this subsection, 17 unknown mobile phases were run, which the images are as follows with their respective numbers, please report the results obtained in the separation for each of the mixtures used as
eluants in terms of the separate pigments listed in the pigment table (below), as well as please explain why such a mobile phase did not work, worked or worked very little, why? What do these results tell us? : (images above)According to subsection D) why is silica gel added? Why is ethanol added to wet the column and not another substance? why does it prevent it from breaking? What happens, why does the latter comply? Why must all the ethanol be permeated in order to add the sample?
What happens if it breaks? What are the pigments obtained in the test tubes? so that?
ALL THIS ACCORDING TO THE FOLLOWING PRACTICE: (I promise to rate them)
Separation of Spinach Leaf Pigments
By Thin Layer Chromatography and ColumnDevelopment:
A) Pigment extraction
1. In a mortar, place a chopped fresh spinach leaf with a mixture of 8 mL hexane and 4 mL
of ethanol, crush gently to obtain a crystalline extract.
2. Using a Pasteur pipet, transfer the crystalline hexane extract (top) to a test tube.
3. Add approximately half the volume of distilled water extract and shake gently
avoiding the formation of emulsions.
4. Transfer the organic phase to a test tube and add Na 2 SO 4 to remove the water.B) Chromatography plate preparation
1. With the help of a pencil, lightly mark the two points where the sample is to be deposited.
2. With a capillary, deposit a little of the sample on the chromatography plate; to prevent the
spread the mixture over the plate, empty the capillary content little by little over the same point (3-5
times), and blow gently to dry the solvent.C) Plate development
1. Prepare 10 mL of the following solvents and mixtures thereof.
- Hexane
- Chloroform
- Acetone
- Ethanol
- Hexane/chloroform (1:1)
- Hexane/acetone (1:1)
- Hexane/acetone (7:3) -
- Hexane/e
2. Prepare and cut paper plates for each of the mobile phases.
3. Run the chromatography and mark with pencil the results obtained for each of the mobile phases.
4. Determine the colors present in each of the separations and calculate the R f for each one.
5. Report the results obtained in the separation for each of the mixtures used as
eluting in terms of the separated pigments, possibly:\begin{tabular}{|l|l|}
\hline \( \begin{array}{l}\text { Pigment } \\
\text { or }\end{array} \) & Color \\
\hline Carotene &6. From the values of R f determined and compared with those reported in the bibliography, indicate which
would be the most suitable mobile phase to carry out the separation.
7. Once the mobile phase is selected, repeat the chromatography on a thin layer plate.
D) Chromatographic column preparation1. To pack the column, place a small piece of cotton on the bottom of a 5-gauge syringe.
mL as a lid, add silica gel up to 80% of the capacity of the syringe and compact it;
place another cotton plug on top of the syringe.
2. Add ethanol to wet the column and prevent it from fracturing.
3. Once all the ethanol has permeated, add the sample and allow it to diffuse through the cotton until
reach the silica gel.
4. Add the mobile phase with which the best separation was observed by thin layer chromatography and
collect the pigments obtained in test tubes (one for each pigment).- Hay 3 pasos para resolver este problema.Solución100% (1 calificación)Paso 1Mira la respuesta completa
Inciso A) Extracción de pigmentos de la espinaca con fines cromatográficos
- ¿por qué se hace una mez...
Paso 2 DesbloqueaPaso 3DesbloqueaRespuestaDesbloquea
DesbloqueaPaso 3DesbloqueaRespuestaDesbloquea

Estudia mejor, ¡ahora en español!
Entiende todos los problemas con explicaciones al instante y pasos fáciles de aprender de la mano de expertos reales.