¡Tu solución está lista!
Nuestra ayuda de expertos desglosó tu problema en una solución confiable y fácil de entender.
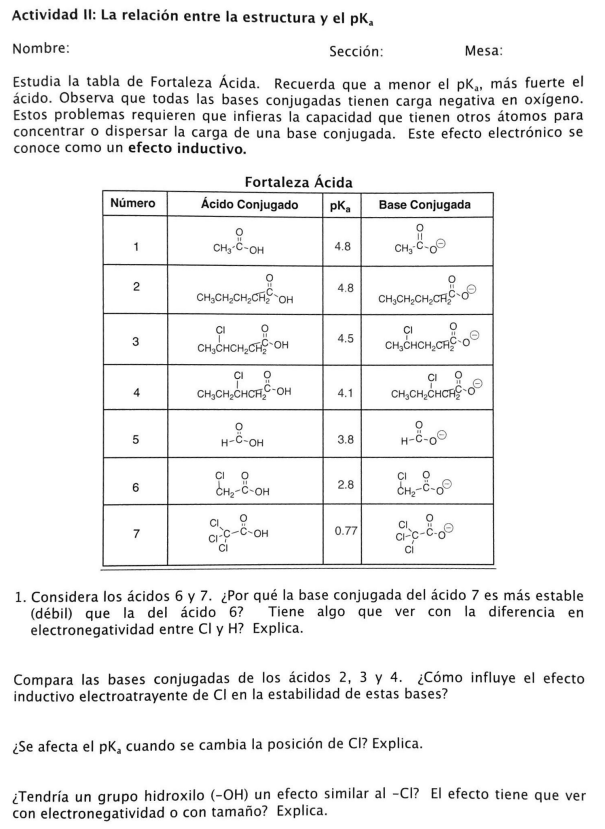
Mira la respuestaMira la respuesta done loadingPregunta: Actividad II: La relación entre la estructura y el pKa Nombre: Sección: Mesa: Estudia la tabla de Fortaleza Ácida. Recuerda que a menor el pKa, más fuerte el ácido. Observa que todas las bases conjugadas tienen carga negativa en oxígeno. Estos problemas requieren que infieras la capacidad que tienen otros átomos para concentrar o dispersar la carga de una
- Intenta enfocarte en un paso a la vez. ¡Tú puedes!SoluciónPaso 1Mira la respuesta completa
vamos a analizar cada caso teniendo en cuenta la estabilidad de la estructura luego de perder un H. ...
Paso 2 DesbloqueaPaso 3DesbloqueaPaso 4DesbloqueaPaso 5DesbloqueaRespuestaDesbloquea
DesbloqueaPaso 3DesbloqueaPaso 4DesbloqueaPaso 5DesbloqueaRespuestaDesbloquea
Texto de la transcripción de la imagen:
Actividad II: La relación entre la estructura y el pKa Nombre: Sección: Mesa: Estudia la tabla de Fortaleza Ácida. Recuerda que a menor el pKa, más fuerte el ácido. Observa que todas las bases conjugadas tienen carga negativa en oxígeno. Estos problemas requieren que infieras la capacidad que tienen otros átomos para concentrar o dispersar la carga de una base conjugada. Este efecto electrónico se conoce como un efecto inductivo. 1. Considera los ácidos 6 y 7 . ¿Por qué la base conjugada del ácido 7 es más estable (débil) que la del ácido 6? Tiene algo que ver con la diferencia en electronegatividad entre Cl y H ? Explica. Compara las bases conjugadas de los ácidos 2, 3 y 4 . ¿Cómo influye el efecto inductivo electroatrayente de Cl en la estabilidad de estas bases? ¿Se afecta el pKa cuando se cambia la posición de Cl ? Explica. ¿Tendría un grupo hidroxilo (−OH) un efecto similar al −Cl ? El efecto tiene que ver con electronegatividad o con tamaño? Explica.

Estudia mejor, ¡ahora en español!
Entiende todos los problemas con explicaciones al instante y pasos fáciles de aprender de la mano de expertos reales.