¡Tu solución está lista!
Nuestra ayuda de expertos desglosó tu problema en una solución confiable y fácil de entender.
Mira la respuestaMira la respuesta done loadingPregunta: 3 moles de agua líquida a 100\deg C y 1atm pasan a fase vapor a 160\deg C y 0.5atm. Calcule \Delta H, \Delta S,\Delta G y \Delta A para el proceso. Puede considerar que el vapor se comporta como gas ideal. Datos del agua que tal vez necesite para resolver el problema:Cpmvap =9calmolK; ΔHmvap =9360calmol; S°298K=16.72calmolK
moles de agua lquida a deg C y atm pasan a fase vapor a deg C y atm. Calcule Delta HDelta SDelta G y Delta A para el proceso. Puede considerar que el vapor se comporta como gas ideal. Datos del agua que tal vez necesite para resolver el problema:; ;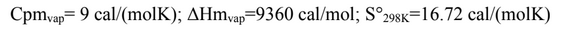
- Intenta enfocarte en un paso a la vez. ¡Tú puedes!SoluciónPaso 1Mira la respuesta completa
Este ejercicio es un problema de termodinámica. El problema nos plantea el cálculo de unas funciones...
Paso 2 DesbloqueaPaso 3DesbloqueaPaso 4DesbloqueaPaso 5DesbloqueaRespuestaDesbloquea
DesbloqueaPaso 3DesbloqueaPaso 4DesbloqueaPaso 5DesbloqueaRespuestaDesbloquea

Estudia mejor, ¡ahora en español!
Entiende todos los problemas con explicaciones al instante y pasos fáciles de aprender de la mano de expertos reales.