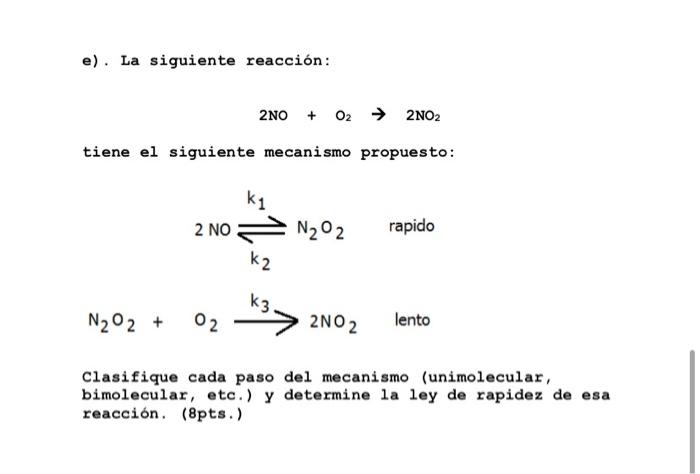
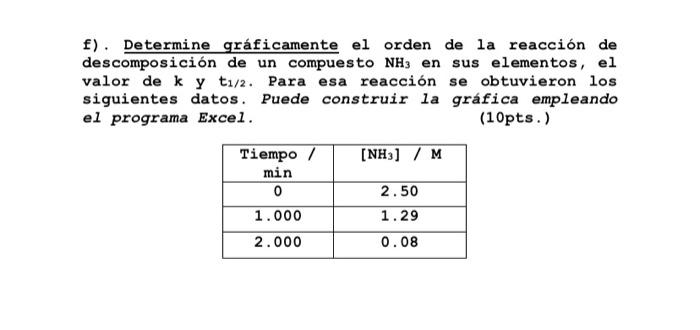
Pregunta: I. Conteste las siguientes preguntas a) Para la siguiente reacción hipotética: 2A + 3B → 5C la [A] bajó de 0.5684M a 0.5522M en 15.0 minutos. ¿Cuál es la rapidez de consumo de B, la de formación de C y la rapidez promedio de la reacción, todas expresadas en M/s? (8pts.) b) Para la siguiente reacción de primer orden a 65°C 2N2O3 → 2N204 + O2 si su tiempo de
- Esta pregunta aún no se resolvió!¿No es lo que buscas?Envía tu pregunta a un experto en la materia.Texto de la transcripción de la imagen:I. Conteste las siguientes preguntas a) Para la siguiente reacción hipotética: 2A + 3B → 5C la [A] bajó de 0.5684M a 0.5522M en 15.0 minutos. ¿Cuál es la rapidez de consumo de B, la de formación de C y la rapidez promedio de la reacción, todas expresadas en M/s? (8pts.) b) Para la siguiente reacción de primer orden a 65°C 2N2O3 → 2N204 + O2 si su tiempo de media vida es 516 segundos, ¿cuál será la concentración de N2os a los 20 minutos de comenzada la reacción si la (N2Os]. = 0.540 M? (8pts.) c) ¿Cuál es el valor del factor f en una reacción que tiene una Ea = 10.5 kJ/mol a 25°C? (8pts. ) d) Discuta la veracidad de la siguiente aseveración (Indi que si es cierta o falsa y por qué): (8pts.) La constante de rapidez depende de la energia de activación. e). La siguiente reacción: 2NO + O2 + 2NO2 tiene el siguiente mecanismo propuesto: k1 2 NON202 rapido k2 k3 N2O2 + + O2 2NO2 lento Clasifique cada paso del mecanismo (unimolecular, bimolecular, etc.) y determine la ley de rapidez de esa reacción. (8pts.) f). Determine gráficamente el orden de la reacción de descomposición de un compuesto NH3 en sus elementos, el valor de k y t1/2. Para esa reacción se obtuvieron los siguientes datos. Puede construir la gráfica empleando el programa Excel. (10pts.) (NH3) / M Tiempo/ min 0 1.000 2.000 2.50 1.29 0.08
Texto de la transcripción de la imagen:
I. Conteste las siguientes preguntas a) Para la siguiente reacción hipotética: 2A + 3B → 5C la [A] bajó de 0.5684M a 0.5522M en 15.0 minutos. ¿Cuál es la rapidez de consumo de B, la de formación de C y la rapidez promedio de la reacción, todas expresadas en M/s? (8pts.)
b) Para la siguiente reacción de primer orden a 65°C 2N2O3 → 2N204 + O2 si su tiempo de media vida es 516 segundos, ¿cuál será la concentración de N2os a los 20 minutos de comenzada la reacción si la (N2Os]. = 0.540 M? (8pts.)
c) ¿Cuál es el valor del factor f en una reacción que tiene una Ea = 10.5 kJ/mol a 25°C? (8pts. )
d) Discuta la veracidad de la siguiente aseveración (Indi que si es cierta o falsa y por qué): (8pts.) La constante de rapidez depende de la energia de activación.
e). La siguiente reacción: 2NO + O2 + 2NO2 tiene el siguiente mecanismo propuesto: k1 2 NON202 rapido k2 k3 N2O2 + + O2 2NO2 lento Clasifique cada paso del mecanismo (unimolecular, bimolecular, etc.) y determine la ley de rapidez de esa reacción. (8pts.)
f). Determine gráficamente el orden de la reacción de descomposición de un compuesto NH3 en sus elementos, el valor de k y t1/2. Para esa reacción se obtuvieron los siguientes datos. Puede construir la gráfica empleando el programa Excel. (10pts.) (NH3) / M Tiempo/ min 0 1.000 2.000 2.50 1.29 0.08

Estudia mejor, ¡ahora en español!
Entiende todos los problemas con explicaciones al instante y pasos fáciles de aprender de la mano de expertos reales.